Profils de chercheurs
F. Jeffrey Dilworth, PhD (English)
jdilworth@ohri.ca
(613) 737-8899 ext.70339
(613) 739-6294
Adresse: Campus Général
Scientifique, Programme de médecine régénératrice, Centre de recherche sur les cellules souches Sprott, Institut de recherche en santé d’Ottawa
Maitre-Assistant, Département de médecine cellulaire et moléculaire, Université d’Ottawa
Maitre-Assistant, Départment de médecine, Université d’Ottawa
Chaire de recherche du Canada en régulation epigenétique de la transcription
Formation
Associé de Recherche - Fred Hutchinson Cancer Research Center (Seattle, WA, Etats-Unis)
Chercheur Post-Doctoral - Institut de Génétique et de Biologie Moléculaire et Cellulaire (Strasbourg, France)
Doctorat (Ph.D.) - Queen’s University (Kingston, ON, Canada)
B.Sc. - Queen’s University (Kingston, ON, Canada)
Programme de Recherche
Régulation de l’expression des gènes pendant le dévelopment chez les mammifères
Mots Clés
Chromatine, Transcription, Expression des gènes, MyoD, Myogenèse, Dévelopment, Epigenétique, Coactivateurs, Promoteurs, Muscle, Dystrophie Musculaire, Cellules Souches
Projets de Recherche
Le but de notre programme de recherche est de comprendre le mécanisme qui contrôle l’expression des gènes spécifiques à certains tissus au cours du development chez les mammifères, afin de pouvoir induire une differentiation cellulaire programmée à partir de cellules souches. Nous étudions le rôle des différents facteurs de transcription épigenétiques impliqués dans le contrôle de la myogenèse, particulièrement MyoD dont l’expression forcée induit la differentiation myogènique à partir de nombreux types cellulaires différents. Afin de résoudre le mécanisme moleculaire par lequel MyoD établit le programme d’expression des gènes exprimés spécifiquement dans le muscle, nous utilisons des approches variées de biochimie, biologie cellulaire, genomique et protéomique.
Nos experiences les plus récentes ont demontré que la proteine ASH2L, qui appartient à la famille des trithorax, ainsi que l’enzyme methyltransferase avec laquelle elle interagit, joue un role fondamental dans le contrôle de l’expression des gènes spécifiques au muscle. En effet, nous avons découvert que l’activateur transcriptionel Mef2d dont les sites de fixation à l’ADN sont souvent associés aux sites de fixation de MyoD, permet le recrutement du complexe ASH2L au niveau des gènes musculaires lors d'un processus contrôllé spécifiquement par la voie de signalisation de la MAP kinase p38. Ces expériences ont révelé pour la première fois un lien entre les voies de signalisation des kinases et la régulation de l’expression des gènes au niveau épigenétique.
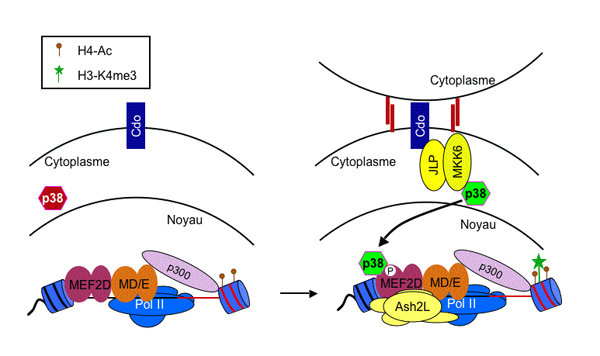
Figure 1. Modèle intègrant la voie de signalisation de la MAP kinase p38 au recrutement du régulateur épigenétique Ash2L au niveau d’un promoteur spécifique aux cellules de muscle par l’activateur Mef2d. Au cours d’une première étape, les facteurs de transcription MyoD/E47(MD/E) et Mef2d collaborent afin de préparer le promoteur via le recrutement de l’acetyltransferase p300 et de la polymérase d’ARN de classe II (Pol II). Cette étape préalable permet l’acétylation de l’histone H4 dans la région du promoteur. Pendant la différentiation, un contact entre deux cellules permet l’activation du récepteur membranaire Cdo qui active la voie de signalisation de la MAP kinase p38 par l’intermédiaire de la protéine d’échafaudage JLP et de la kinase MKK6 (Takaesu et al. J Cell Biol 175: 383). Dès son activation, p38 phosphoryle le facteur de transcription Mef2d, entrainant le recrutement du complexe enzymatique methyltransferase Ash2L au niveau des gènes exprimés specifiquement dans le muscle. La liaison du complexe Ash2L sur les promoteurs de ces genes permet ensuite l’établissement de la modification épigenétique H3K4me3 qui marque spécifiquement les genes actifs dont l’expression est regulée au cours du dévelopement.
Publications Representative
M. Brand, S. Rampalli, C-P. Chaturverdi, and F.J. Dilworth. Analysis of epigenetic modifications of chromatin at specific gene loci by native chromatin immunoprecipitation (N-ChIP) of nucleosomes isolated using hydroxyapatite chromatography. Nature Protocols 3: 398-409, 2008.
I.W. McKinnell, J. Ishibashi, F. LeGrand, V.J.G. Punch, G. Addicks, J.F. Greenblatt, F.J. Dilworth, and M.A. Rudnicki. Pax7 activates myogenic genes by recruitment of a histone methyltransferase complex. Nature Cell Biology 10: 77-84, 2008.
S. Rampalli, L. Li, E. Mak, K. Ge, M. Brand, S.J. Tapscott, and F.J. Dilworth. p38 MAPK signaling pathway regulates recruitment of Ash2L-containing methyltransferase complexes to specific genes during differentiation. Nature Struct Mol Biol 14: 1150-1156, 2007. Publication recommended by Faculty of 1000 Biology.
C. Demers, J.A. Ranish, G. Juban, P. Lai, F. Morle, R. Aebersold, F.J. Dilworth, M. Groudine, and M. Brand. Activator-mediated recruitment of the MLL2 methyltransferase complex to the b-globin locus. Molecular Cell 27: 573-584, 2007.
G. Caretti, R.L. Schiltz, F.J. Dilworth, M. Di Padova, P. Zhao, V. Ogryzko, F.V. Fuller-Pace, E.P. Hoffman, S.J. Tapscott, and V. Sartorelli. The RNA helicases p68/p72 and the noncoding RNA SRA are coregulators of MyoD and skeletal muscle differentiation. Developmental Cell 11: 547-560, 2006.
R. Pavri, B. Lewis, T-K. Kim, F.J. Dilworth, H. Erdjument-Bromage, P. Tempst, G. de Murcia, R. Evans, P. Chambon, and D. Reinberg. PARP-1 determines specificity in a retinoid signaling pathway via direct modulation of mediator. Molecular Cell 18: 83-96, 2005. Publication recommended by Faculty of 1000 Biology.
F.J. Dilworth, K. Seaver, A. Fishburn, S. Htet, and S.J. Tapscott. In vitro transcription system delineates the distinct roles of the coactivators pCAF and p300 during MyoD/E47-dependent transactivation. Proceedings of the National Academy of Science USA 101 : 11593-11598, 2004.
B.H. Penn, D.A. Bergstrom, F.J. Dilworth, E. Bengal, and S.J. Tapscott. A MyoD-generated feed-forward circuit temporally patterns gene expression during skeletal muscle differentiation. Genes & Development 18: 2348-2353, 2004.
F.J. Dilworth, and P. Chambon. Nuclear receptors coordinate the activities of chromatin remodeling complexes and coactivators to facilitate initiation of transcription. Oncogene 20: 3047-3054, 2001.
F.J. Dilworth, C. Fromental-Ramain, K. Yamamoto, and P. Chambon. ATP-driven chromatin remodeling activity and histone acetyltransferases act sequentially during transactivation by RAR/RXR in vitro. Molecular Cell 6: 1049-1058, 2000.
F.J. Dilworth, C. Fromental-Ramain, E. Remboutsika, A. Benecke, and P. Chambon. Ligand-dependent activation of transcription in vitro by retinoic acid receptor a /retinoid X receptor a heterodimers that mimics transactivation by retinoids in vivo. Proceedings of the National Academy of Science USA 96: 1995-2000, 1999.
Notre Recherche Est Financée Par Les Organisations Suivantes:
Instituts de Recherche en Sante du Canada
Chaire de Recherche du Canada
Fondation Canadienne pour l’Innovation
Ministere de la Recherche et de L’Innovation
Membres de l’Equipe Actuel
Shayesta Seenundun – Stagière Post-doctorale (Boursière de la FRSQ) - sseenundun@ohri.ca
Qi-Cai Liu – Stagier Post-doctorale - qliu@ohri.ca
Patricia Rakopoulos – Etudiante de thèse - prakopoulos@ohri.ca
Esther Mak – Gestionnaire du Laboratoire / Technicienne - emak@ohri.ca
LiFang Li – Technicienne - lili@ohri.ca
Ancient Membres de l’Equipe
Shravanti Rampalli – Stagière Post-doctorale (Bhatia Lab - Stem Cell and Cancer Research Institute, Hamilton, ON, Canada)
Processus pour Integrer Notre Laboratoire:
Stage Post-Doctoral – Veuillez s’il vous plait, envoyer une copie de votre CV, ainsi qu’une brève description de vos buts de carrière.
Etudiant de thèse – Veuillez s’il vous plait, envoyer une copie de votre CV, vos transcrits universitaires, ainsi qu’une brève description de vos buts de carrière.